Anna Maria Schimizzi, Marco Candela
Dipartimento di Medicina
UOC Medicina Interna Jesi - Area Vasta 2 Asur Marche
Scenario clinico
Uomo di 64 anni giunge all'osservazione clinica in regime ambulatoriale per progressivo incremento volumetrico addominale da circa due mesi associato ad astenia. Porta in visione esami ematochimici di I livello prescritti dal proprio Medico di Medicina Generale che rilevano alterazioni degli indici di citolisi e di colestasi epatica (AST x 1,5 v.n.; ALT x 2 v.n.; GGT x 4 v.n.) ed una lieve piastrinopenia (PLT 100.000/mmc) mentre indagini sierologiche non evidenziano una matrice virologica a carico dei principali agenti epatotropi (HAV, HBV, HCV, HEV, CMV, EBV). Una ecografia, ugualmente prescritta dal curante, evidenzia una modesta epatomegalia a prevalente componente steatosica.
All'anamnesi emergono una familiarità per cardiopatia ischemica e le seguenti comorbidità: ipertensione arteriosa in trattamento farmacologico, diabete di tipo 2 in trattamento con ipoglicemizzanti orali (metformina), dislipidemia di recente insorgenza non ancora trattata (né in termini di modifica abitudini di vita né farmacologicamente) nonché tabagismo. All'esame obiettivo si rileva un'obesità severa (BMI 33) ed una circonferenza addominale di 124 cm. Vengono confermati l'epatomegalia (fegato debordante di due dita dall'arcata costale, con margine liscio e di consistenza normale), la presenza di versamento libero addominale senza i caratteri di una ascite tesa, lievi edemi periferici, presenza di stasi polmonare alla base destra.
Alla luce dei dati raccolti, viene definito quale problema clinico attivo la comparsa di uno SCOMPENSO EPATICO IN PAZIENTE CON EPATOPATIA CRONICA DI NDD E SINDROME METABOLICA.
Sulla base dei dati raccolti le ipotesi formulate quali più probabili nel caso osservato sono:
- STEATOEPATITE NON ALCOLICA (non alcoholic steatohepatitis – NASH ) QUALE COMPONENTE DI UNA SINDROME METABOLICA
- EPATITI AUTOIMMUNI, COLANGITE BILIARE PRIMITIVA, COLANGITE SCLEROSANTE
- EMOCROMATOSI
- MALATTIA CELIACA
QUESITI DIAGNOSTICI
In questo paziente, quali ulteriori accertamenti laboratoristico-strumentali possono essere indicati quale piano di studio per una verifica delle ipotesi formulate? Qualora si trattasse di una NASH, quali adempimenti possono favorirne la diagnosi?
La NASH è caratterizzata dalla coesistenza di grasso in eccesso e infiammazione epatocitaria cronica che, nel tempo, può causare danni cellulari in grado di evolvere verso processi fibrotici irreversibili (cirrosi epatica con complicanze, epatocarcinoma).
L'eziologia è multifattoriale. Fattori di rischio per lo sviluppo di NASH includono l'obesità, l'insulino-resistenza, l'ipertrigliceridemia, la sindrome metabolica, il diabete di tipo 2.
Stabilire una precisa diagnosi di NASH può essere difficile. Così come tutte le epatopatie croniche, la clinica è aspecifica e può consistere unicamente nella comparsa di astenia e spesso la diagnosi è tardiva, alla comparsa, come nel caso clinico considerato, di segni di scompenso epatico. Parimenti la diagnostica di laboratorio non sempre è di aiuto. Il rapporto AST/ALT è spesso <1; in alcuni casi GGT e ALP sono lievemente elevate; ipertrigliceridemia e ipercolesterolemia sono spesso presenti.
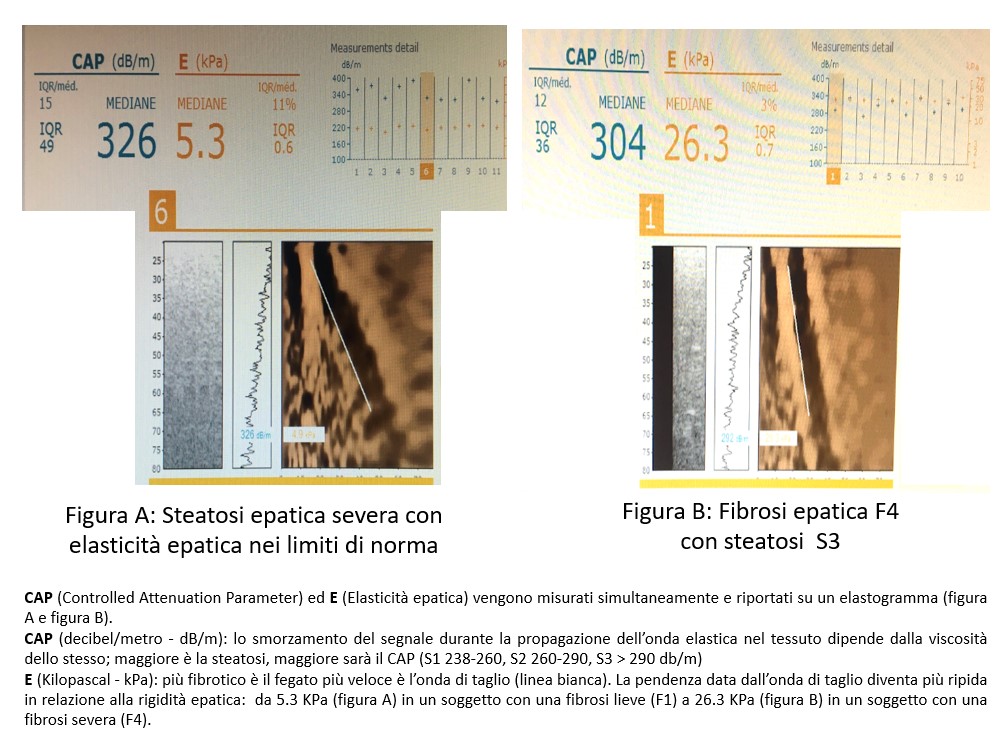
Alcuni criteri di esclusione possono esserci di aiuto, quali la negatività anamnestica per il consumo di alcol, la negatività dei marcatori sierologici virali e immunologici, l'assenza di mutazioni genetiche HFE (quest’ultime da riservare a casi con ferritinemia elevata). L’indiscutibile metodica validata per diagnosticare la NASH con assoluta sicurezza rimane quindi la biopsia epatica, indagine che, in quanto invasiva, ha favorito, negli ultimi anni, l’impiego del fibroscan, uno strumento diagnostico ad ultrasuoni, non invasivo e indolore, che consente di valutare senza alcun rischio il grado di elasticità del fegato (fibrosi lieve, moderata o severa), definendo in questo modo la gravità del quadro clinico, nonchè la presenza di steatosi quantificandola in assente, lieve, moderata-severa.
Nel caso clinico in questione nell’ambito del piano di studio per la verifica delle ipotesi, l’anamnesi è stata orientata a valutare eventuali abitudini all’assunzione di alcol e farmaci; sono stati richiesti accertamenti laboratoristici, tra cui: assetto lipidico (colesterolo totale + HDL + LDL, trigliceridi) e glicemico (glicemia a digiuno e dopo 2 h dal pasto, Hb glicata, dosaggio insulinemia e c-peptide), ferritinemia e saturazione della transferrina, alfafetoproteina, albuminemia, elettroforesi proteica, dosaggio immunoglobulinico, sieroimmunologia sistemica ed anti-fegato (p-ANCA, Ab anti-endomisio e anti-transglutaminasi, ANA, AMA, ASMA, anti-LKM1). Infine, il paziente è stato sottoposto a RMN addome superiore con mdc epatospecifico, per escludere la presenza di processi eteroproliferativi a carico del fegato, e fibroscan per la valutazione della elasticità e della steatosi epatica.
I risultati emersi non deponevano per definite cause di epatopatia cronica (forme post-virali, emocromatosi, malattia celiaca, epatopatie autoimmuni), mentre si rilevava una glicemia a digiuno elevata (145 mg/dl) ed una Hb glicata ai limiti superiori della norma (53 mmol/mol) a testimonianza dello scarso controllo della glicemia con la terapia assunta dal paziente (metformina 1,5 grammi al dì); era presente, inoltre, una dislipidemia importante (Col tot 270 mg/dl, LDL 170 mg/dl, HDL 35 mg/dl; trigliceridi 325 mg/dl). Il fibroscan rilevava la presenza di una fibrosi moderata/severa (12 KPa) ed una steatosi severa (S3) e la RMN addome superiore confermava la componente prevalentemente steatosica in assenza di lesioni focali.
Alla luce di tali dati, in particolare la negatività all’assunzione di alcol e farmaci, l’assenza di iperferritinemia, la negatività delle indagini virologiche ed immunologiche, ed in presenza di fattori di rischio quali la sindrome metabolica (obesità, dislipidemia, diabete, ipertensione arteriosa), veniva posta diagnosi di: NASH COMPLICATA DA SCOMPENSO EPATICO IN PAZIENTE AFFETTO DA SINDROME METABOLICA.
QUESITO TERAPEUTICO
Quali trattamenti sono proponibili in un paziente affetto da NASH?
Poiché la patogenesi della NASH presenta ancora aree grigie di definizione, la terapia si limita principalmente al trattamento delle condizioni associate, come il diabete, l’obesità, la dislipidemia.
Pur osservando, nell'ultimo decennio, un progressivo floruit di studi e di nuove potenziali molecole per il trattamento della NASH, non si dispone, ad oggi, di una terapia eziopatogenetica approvata dalle Autorità Sanitarie a livello mondiale.
Il calo del peso corporeo tramite la riduzione dell’intake calorico ed una costante attività fisica, così come il controllo della glicemia ed il trattamento della dislipidemia, sono fortemente raccomandati dalle varie Società Scientifiche (1).
In questo contesto, i glitazoni sono una classe di farmaci che sono stati usati per trattare la NASH. I glitazoni aumentano la capacità di regolare l'adiponectina, un'adipochina con proprietà antisteatogeniche e insulino-sensibilizzanti, che aumenta la sintesi e l'assorbimento degli acidi grassi da parte degli adipociti, piuttosto che il loro assorbimento da parte di organi come il fegato e i muscoli. In particolare, il pioglitazone ha dimostrato di migliorare l’istologia della NASH in termini di steatosi, infiammazione e balloning degli epatociti; tuttavia questi effetti benefici non sono osservabili nel tempo, con un aumento dei valori sierici di ALT e la ricomparsa della NASH dopo l'interruzione del trattamento. Inoltre, vi sono ulteriori preoccupazioni relative all'aumento di peso che può accompagnare l'uso del pioglitazone (2).
La vitamina E, quale antiossidante in grado di bloccare la via intrinseca dell’apoptosi e limitare il danno ossidativo epatico in corso di NASH, è stata testata nel trial PIVENS dimostrando che può migliorare la fibrosi e l’infiammazione (2), ma non ci sono dati sull’uso prolungato, risultato, in letteratura, in qualche modo legato ad un’aumentata incidenza di stroke emorragico e di neoplasia prostatica (2).
Il Liraglutide, un agonista del peptide 1 glucagone-simile a lunga durata (GLP-1), secreto dopo aver mangiato dalle cellule L dell'intestino tenue e del colon prossimale, stimola la secrezione di insulina da parte delle cellule beta del pancreas, diminuisce la produzione di glucosio epatico, aumenta la sazietà ritardando lo svuotamento gastrico e ha effetti cardioprotettivi. Il GLP-1 ha un'emivita inferiore a 2 minuti, mentre liraglutide, analogo sintetico, ha un'emivita che consente una singola somministrazione giornaliera. In uno studio di fase 2, l'iniezione sottocutanea una volta al giorno di liraglutide 1,8 mg ha determinato la risoluzione della NASH, migliorando contemporaneamente i principali fattori di rischio metabolico (peso, indice di massa corporea, livello di glucosio e HDL) con effetti collaterali minimi, principalmente gastrointestinali. Sono attesi studi di fase 3 per confermare questi dati preliminari (2).
Recentemente c’è stato inoltre molto interesse verso farmaci anti-fibrotici e non sia in monoterapia che in combinazione. Uno dei farmaci di cui è in corso uno studio di fase 3 per la NASH è l'acido obeticolico (OCA), che è un agonista del recettore farnesoide X (FXR) le cui azioni potenziali includono la riduzione della steatosi epatica, dell'infiammazione e della fibrosi aumentando la sensibilità all'insulina. Un altro farmaco in fase 3 di studio è l’elafibranor, un doppio agonista del Peroxisome Proliferator Activated Receptor - PPAR alfa e delta, anch’esso aumentando la sensibilità all’insulina rappresenta un potenziale trattamento per la NASH. Infine, il selonsertib è anch’esso in fase 3 di studio, quale inibitore dell’ASK-1 che promuove infiammazione, apoptosi e fibrosi, il cui uso ha portato ad un miglioramento nei modelli animali di NASH (2).
Ad ogni modo, come già accennato, nessuno di questi, da solo o in combinazione, ha oggi un’indicazione approvata dalle Agenzie regolatorie.
Alla luce di tali considerazioni oggi i pazienti affetti da NASH possono concretamente evitare o rallentare la progressione di malattia cambiando il loro stile di vita in modo efficiente e sostenuto nel tempo (calo ponderale durevole di almeno il 10% del peso corporeo al baseline ed esercizio fisico costante) con un impatto importante sulla patologia e persino sulla fibrosi.
Ritornando al nostro paziente, gli è stata fornita una dieta specifica per steatoepatite ed invitato ad un esercizio fisico quotidiano (una camminata di almeno 30 minuti al dì); inoltre è stato confermato il trattamento per il diabete con metformina aumentandone il dosaggio a 2 g al dì (la normalizzazione dei valori della glicemia è parte integrante della terapia della NASH) e un trattamento della dislipidemia con pravastatina e fibrati. Il paziente è stato trattato anche con acido ursodesossicolico alla luce di alcuni dati preliminari in quanto in grado di ridurre l’espressione di TNF-alfa nella colestasi, l’insulino-resistenza e probabilmente anche il danno ossidativo (1,2).
Inoltre, il nostro paziente è stato trattato per l’iniziale scompenso epatico con diuretici dell’ansa e risparmiatori di potassio.
Il cambiamento dello stile di vita ed il trattamento per il controllo dei fattori di rischio hanno avuto un impatto importante sulla steatosi e fibrosi epatica. Il controllo clinico a distanza di 6 mesi ha rilevato una riduzione del peso corporeo del 20%, una normalizzazione dei valori glicemici e dell’assetto lipidico e, parallelamente, un netto miglioramento della steatosi epatica (da severa a moderata, da S3 a S2) e della fibrosi (da F3/F4 a F2/F3) rilevate al fibroscan di controllo.
QUESITO PROGNOSTICO
Qual è la prognosi dei pazienti affetti da NASH?
Tutti i pazienti con NASH dovrebbero essere valutati per rischio di malattia cardiovascolare e per la presenza di tradizionali fattori di rischio quali obesità, diabete, dislipidemia, ipertensione arteriosa e sindrome metabolica e tale valutazione andrebbe effettuata almeno annualmente. La sindrome metabolica in particolare (definita dal National Cholesterol Education Program, NCEP, come la presenza di almeno 3 o più delle seguenti componenti: aumento dei trigliceridi > 150 mg/dL, ridotti livelli di HDL-Colesterolo <40 mg/dL negli uomini e 50 mg/dL nelle donne, aumento dei livelli di glicemia a digiuno >110 mg/dL, ipertensione o terapia antipertensiva, circonferenza addominale >102 cm nell’uomo e 88 cm nella donna), è risultata associata con aumentato rischio cardiovascolare e mortalità nel paziente con NASH (3).
Diverse evidenze della letteratura negli ultimi anni hanno evidenziato un sostanziale legame tra NASH e malattia cardiovascolare (dalla coronaropatia alla ateromasia carotidea subclinica) tanto da risultare, quest’ultima, principale causa di morte (1,3). Ciò enfatizza la stratificazione del rischio cardiovascolare improrogabile quanto necessaria ai fini di predire la morbidità e la mortalità in tale setting di pazienti. Diversi meccanismi sono stati ipotizzati per lo sviluppo di aterosclerosi “accelerate” in pazienti con NASH, quali predisposizione genetica, insulino- resistenza, dislipidemia aterogenetica, stress ossidativo, infiammazione cronica, ridotti livelli di adiponectina e alterata produzione di fattori pro e anticoagulanti (4). Nel nostro paziente il Framingham Risk Score cardiovascolare a 10 anni stimato è risultato >30% (alto rischio) ed è stato quindi sottoposto a ECG, valutazione cardiologica con ecocardiogramma ed ecodoppler dei vasi epiaortici del collo, risultati negativi per problematiche vascolari emodinamicamente significative. Il monitoraggio del rischio cardiovascolare dovrà essere mantenuto almeno annualmente, come in tutti i pazienti affetti da NASH.
QUESITO GESTIONALE
Quali considerazioni possono essere formulate nell’ottica di un precoce case finding e di un corretto management di pazienti con NASH?
Il sospetto che un paziente sia portatore di NASH può originare da una serie di osservazioni, quali l’evidenza di una ipertransaminasemia altrimenti non inquadrabile, l’esclusione di un potus superiore ai 30 g/die di alcol nel sesso maschile e 20 g/die nel sesso femminile, la presenza di fattori di rischio quali la sindrome metabolica e l’insulino-resistenza, il riscontro ecografico occasionale di iperecogenicità epatica. La precoce identificazione del paziente con NASH, la stadiazione del danno d’organo, l’inquadramento complessivo generale ed un precoce intervento personalizzato di terapia e monitoraggio sono azioni essenziali per la cura ottimale di questi pazienti e per garantire, nello stesso tempo, la sostenibilità economica degli interventi sanitari. Una gestione condivisa basata sulla stretta collaborazione tra Medico di Medicina Generale (MMG), specialista Epatologo e altri specialisti (internista, diabetologo, cardiologo, ecc.), appare particolarmente necessaria affinchè il percorso assistenziale complessivo del paziente con NASH sia caratterizzato da appropriatezza diagnostico-terapeutica, coerente con l’evoluzione cronica della malattia (5).
La maggior parte delle epatopatie croniche sono caratterizzate da una graduale progressione verso la fibrosi, la cirrosi e lo sviluppo di epatocarcinoma, talora secondo un iter non sequenziale in quanto, negli ultimi anni, si è registrato un aumento di epatocarcinoma in pazienti affetti da NASH senza alcuna evidenza di cirrosi. Infatti, ad oggi meno del 50% degli epatocarcinomi su NASH insorgono su fegati cirrotici, a differenza delle altre epatopatie croniche in cui la percentuale è compresa tra il 70 e 99%. Di conseguenza, i meccanismi responsabili della evoluzione verso l’epatocarcinoma non possono essere attribuiti in toto ai processi fibrotici, così da enfatizzare pathway alternativi nei meccanismi di oncogenesi.
Recenti studi hanno identificato la NASH quale seconda causa di trapianto epatico in Europa per HCC e, alla luce della ormai innegabile efficacia dei trattamenti antivirali per l’epatite C, in futuro ne diventerà presumibilmente la principale (6).
L’applicazione di programmi di screening limitati ai soli pazienti cirrotici può spesso rappresentare, quindi, un elevato rischio di ritardo diagnostico nei soggetti affetti da forme avanzate di fibrosi epatica. Sebbene lo screening per HCC in pazienti non cirrotici non sia attualmente raccomandato dalle linee-guida, è auspicabile che in futuro strumenti di selezione degli individui a più alto rischio di neoplasia vengano identificati al fine di stratificare la popolazione generale e permettere l’elaborazione di strategie di sorveglianza più mirate.
Per ottenere risultati ottimali nella gestione dei pazienti con NASH in termini di aderenza ai programmi terapeutici (in particolare ai programmi dietetici e di stile di vita) e di raggiungimento dei target terapeutici, devono essere applicati modelli basati su un approccio integrato che necessita di un attivo engagement del paziente al percorso di diagnosi e cura e che include interventi educativi volti ad incrementare la conoscenza della malattia, la dannosità dei fattori di rischio ad essa collegati e la consapevolezza delle potenzialità evolutive della stessa. In questo contesto il Medico di Medicina Generale ha il compito fondamentale di aiutare il paziente ad identificare gli obiettivi e i traguardi da raggiungere attraverso lo sviluppo di piani di azione basati su decisioni condivise. Lo specialista interviene in questo percorso rafforzando il programma educativo e personalizzandolo secondo la gravità della epatopatia e le comorbidità associate.
BIBLIOGRAFIA
- EASL–EASD–EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. European Association for the Study of the Liver (EASL), European Association for the Study of Diabetes (EASD) and European Association for the Study of Obesity (EASO); Journal of Hepatology 2016 vol. 64 j 1388–1402
- Zobair M. Younossi, et al. Current and Future Therapeutic Regimens for Nonalcoholic Fatty Liver Disease and Nonalcoholic Steatohepatitis. HEPATOLOGY, vol. 68, no. 1, 2018: 361-
- Hannes Hagström et al. Cardiovascular Risk Factors in Non-alcoholic Fatty Liver Disease Liver International. 2018;39(1):197-204.
- Nwe Ni Than, Philip N. Newsome.A concise review of non-alcoholic fatty liver disease Atherosclerosis 239 (2015) 192-202
- Steatosi epatica non alcolica (NAFLD). Raccomandazioni per un modello di gestione condivisa tra medico di medicina generale e specialista epatologo. Web AISF 2015
- Lonardo A, Nascimbeni F, et al. AISF position paper on nonalcoholic fatty liver disease (NAFLD): Updates and future directions. Digestive and Liver Disease May 2017; Volume 49, Issue 5, Pages 471–483