Enrico Strocchi, Matteo Landolfo, Claudio Borghi
Dipartimento di Scienze Mediche e Chirugiche, Clinica di Medicina Interna
Università di Bologna
Scenario clinico
Una donna di 66 anni, affetta da obesità moderata ed ipertensione arteriosa sistemica, non in terapia farmacologica, con anamnesi negativa per altre patologie di rilievo, si presenta al pronto soccorso del nostro policlinico per la comparsa e il progressivo peggioramento di dispnea da sforzo associata a gonfiore bilaterale agli arti inferiori.
All’arrivo in PS, vengono rilevati i principali parametri vitali ed effettuato un esame fisico completo: PA 178/86 mmHg, FC 84 bpm, pSATO2 94%, TC 36°C; all’esame obiettivo la paziente è eupnoica a riposo ma vengono evidenziati, oltre alla presenza di edemi improntabili bilaterali agli arti inferiori, anche dei rantoli ad entrambe le basi polmonari.
I medici del PS, con il sospetto clinico di scompenso cardiaco decidono di eseguire:
- ECG: ritmo sinusale, FC 84 bpm, segni di ipertrofia ventricolare sinistra.
- Rx torace: segni di congestione del piccolo circolo, lieve velatura dei recessi costofrenici, ombra cardiaca ingrandita.
- Laboratorio: BNP 421 pg/mL; nella norma i restanti parametri, in particolare l’emoglobina, gli indici di funzionalità renale e gli elettroliti sierici così come gli indici di flogosi.
- Ecocardiografia transtoracica: ipertrofia concentrica del ventricolo sinistro, lieve-moderata disfunzione diastolica (E/A 0.8, E/E’ 17), conservata la funzione sistolica (FE 60%), lieve incremento delle pressioni polmonari stimate (PAPS 30-40 mmHg) e lieve incremento dimensionale biatriale.
La paziente viene trattata con furosemide ev e trasferita nel nostro reparto di Medicina Interna con la diagnosi di “Scompenso cardiaco a frazione di eiezione preservata”.
Durante le prime giornate di degenza, nonostante la terapia diuretica si rilevano scarse modificazioni degli edemi declivi presenti al momento del ricovero e l’estensione degli stessi anche al volto ed alle mani, con conseguente mancato calo ponderale.
Considerato il quadro clinico e la scarsa risposta alla terapia diuretica, le ipotesi diagnostiche che vengono considerate sono:
- presenza di processi patologici aggiuntivi che possano contribuire al quadro di scompenso cardiaco ed edema generalizzato, come ad esempio ipotiroidismo ed ipoalbuminemia di varia origine;
- resistenza alla terapia diuretica;
Il medico decide quindi di associare alla terapia con furosemide una piccola dose di metolazone e di richiedere alcuni esami di approfondimento, nello specifico:
- esame chimico-fisico delle urine: albumina > 200 mg/dL, lieve glicosuria, assenti ematuria, cilindri ematici e cilindri cellulari.
- glicemia, emoglobina glicata: 356 mg/dL, HbA1C 16%
- albumina plasmatica: 1.77 g/dL
- TSH: nella norma
- test emocoagulativi: nella norma
- bilirubina totale: nella norma
La paziente risulta avere un diabete mellito scompensato, una severa ipoalbuminemia, in assenza di altri segni di insufficienza epatica ed una albuminuria degna di ulteriori accertamenti; nel sospetto di una sindrome nefrosica vengono pertanto valutati:
- proteinuria delle 24 ore: 10.9 g/die
- elettroforesi delle proteine sieriche: ipoalbuminemia, aumento della frazione beta, non alterazioni della frazione gamma.
- immunofissazione urinaria negativa
- colesterolemia totale: 333 mg/dL
- C3 e C4 nella norma
Viene posta quindi la diagnosi di “Sindrome nefrosica in paziente diabetica” ed aggiunta terapia con ACE-inibitore, profilassi antitrombotica, insulina e metformina.
Quesito diagnostico 1: considerata la storia clinica e il risultato degli esami ematochimici disponibili, è comunque necessaria l’esecuzione di una biopsia renale per confermare l’eziologia della glomerulopatia alla base della sindrome nefrosica?
La biopsia renale può essere utile per effettuare una corretta diagnosi e per la valutazione del grado di attività dalla malattia e per guidare la scelta della terapia e verificarne la risposta; tuttavia l’indicazione e l’interpretazione dei risultati dell’eventuale biopsia devono essere valutati nel contesto clinico e degli altri risultati degli esami di laboratorio.
In corso di sindrome nefrosica idiopatica, la biopsia renale viene eseguita per distinguere tra le 3 principali cause: minimal change disease, glomerulosclerosi segmentale focale e glomerulonefrite membranosa in quanto il risultato può modificare la gestione clinica e terapeutica in più del 75% dei casi. Ad esempio una proteinuria non selettiva potrebbe essere la modalità di presentazione del danno renale in corso di LES anche in assenza delle alterazioni sierologiche tipiche; inoltre, nei pazienti con LES già diagnosticato, la biopsia è utile per valutare l’eventuale presenza ed il tipo di danno renale.
Tuttavia, nei pazienti con sindrome nefrosica nel contesto di un diabete mellito scompensato, di lungo corso ed in assenza di altri segni di coinvolgimento glomerulare primitivo (assenza di ematuria e cilinidri al chimico-fisico urinario, sierologia negativa, assenza di immunocomplessi..) la biopsia potrebbe non essere necessaria per confermare la diagnosi di nefropatia diabetica, anche se in qualche caso potrebbe concomitare anche una causa di nefropatia non-diabetica.
Quesito diagnostico 2: in quale tipo di disfunzione cardiaca l’ipoalbuminemia secondaria alla sindrome nefrosica, è più frequentemente causa scatenante dello scompenso? Qual è la posizione delle linee guida internazionali al riguardo?
La presenza di ipoalbuminemia è più frequentemente causa della congestione polmonare e della persistenza degli edemi in condizioni di disfunzione diastolica ed aumentate pressioni atriali.
L’ipoalbuminemia favorirebbe inoltre una certa quota di edema del miocardico, con conseguenze negative sulla funzionalità cardiaca, sistolica e diastolica.
L’albumina possiede una funzione antiossidante ed alcune proprietà anti-infiammatorie, che in presenza di ipoalbuminemia verrebbero a mancare, creando ulteriori presupposti per un peggioramento dell’insufficienza cardiaca.
Nonostante questi molteplici effetti negativi dell’ipoalbuminemia sulla funzione cardiaca, le linee guida internazionali (ESC 2016) non elencano l’ipoalbuminemia, indipendentemente dalla sua origine, tra le possibili cause scatenanti la sindrome clinica dello scompenso cardiaco (Tab. 1 – fattori scatenanti lo scompenso cardiaco acuto).
Inoltre, le stesse linee guida non trattano in maniera esaustiva l’impatto negativo che la disfunzione renale può avere sull’insorgenza di scompenso cardiaco, limitandosi a considerare la possibilità che le due patologie coesistano, gli effetti negativi sulla funzione renale di una terapia diuretica troppo drastica o di farmaci bloccanti il sistema RAA, senza prendere in esame altre forme di alterata funzione renale, come ad esempio la proteinuria massiva propria della sindrome nefrosica, che possano contribuire alla genesi dello scompenso cardiaco.
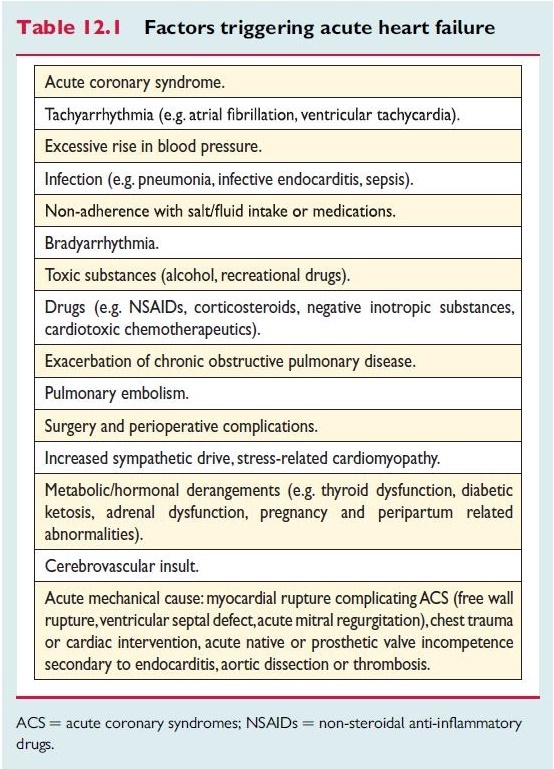
Tab. 1: fattori scatenanti lo scompenso cardiaco acuto (tabella riprodotta dal testo “2016 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure” European Heart Journal 2016, pag. 2171)
Quesito terapeutico: con quale/i meccanismo/i l’ipoalbuminemia può determinare una resistenza alla terapia diuretica? Quali potrebbero essere le soluzioni farmacologiche al problema?
Oltre a facilitare l’insorgenza e la persistenza di edemi secondariamente alla riduzione della pressione oncotica plasmatica, l’ipoalbuminemia può determinare un certo grado di resistenza alla terapia diuretica, tramite alcuni particolari meccanismi.
La quota di diuretico che viene trasportata al rene in corso di ipoalbuminemia è fortemente ridotta; infatti, la furosemide ha un elevato legame proteico proprio con l’albumina, insieme alla quale arriva al rene dove viene secreta nel tubulo, al fine di raggiungere il suo sito d’azione finale.
In caso di importante albuminuria, il farmaco secreto nel tubulo, viene nuovamente legato all’albumina filtrata che ne impedisce il legame al sito d’azione.
In ultimo, in condizione di proteinuria non selettiva, come accade nella sindrome nefrosica, il plasminogeno filtrato sarebbe responsabile di una attivazione proteolitica dei canali epiteliali del sodio (ENAC) a livello dei tubuli collettori, portando ad una impropria ricaptazione renale di sodio e quindi ad una minore efficacia natriuretica e diuretica.
Una terapia diuretica di associazione con amiloride, antagonista degli ENAC, potrebbe essere una possibile soluzione d’impiego.
Quesito prognostisco: qual è l’impatto dell’ipoalbuminemia sulla prognosi dei pazienti ospedalizzati? E’ un parametro che dovrebbe essere valutato routinariamente nel malato con scompenso cardiaco e scarsa risposta alla terapia? Ha senso reinfondere l’albumina persa?
Nel paziente con scompenso cardiaco, pur mancando in letteratura dati specifici sull’impatto della sindrome nefrosica, viene evidenziata una prognosi peggiore in presenza di ipoalbuminemia, indipendentemente dal setting emodinamico (FE ridotta o preservata), che si manteneva anche ad un anno dalla misurazione puntuale. Alcuni studi condotti effettuando dei controlli longitudinali dei valori di albumina durante il periodo di degenza, hanno mostrato una significativa migliore prognosi (mortalità ed ospedalizzazione ridotti) nei pazienti con scompenso cardiaco che vedevano un incremento progressivo dei valori di albumina.
L’infusione di albumina in pazienti critici con edema polmonare (tuttavia non secondario a scompenso cardiaco) ha migliorato la capacità di eliminare liquidi in eccesso e la performance respiratoria. Agli stessi pazienti, nello studio SAFE, l’unico randomizzato e controllato, la somministrazione di albumina rispetto alla sola soluzione fisiologica non ha dato luogo a differenze significative quanto a mortalità ad 1 mese dall’evento acuto.
Nonostante questi risultati, nel contesto di ipoalbuminemia da sindrome nefrosica, ogni tentativo di reintegrare l’albumina persa con le urine risulterebbe infruttuosa, per cui attualmente non sussiste alcuna indicazione.